Kdo smo
Veletrgovec z najširšo ponudbo zdravil.
Veletrgovec, ki s svojimi storitvami kupcem ponuja najboljše rešitve - distribucija, informacije, svetovanje, poslovanje.
Veletrgovec, ki z zdravili in medicinskimi pripomočki pokriva vso Slovenijo.
Evropski parlament je 5. aprila 2017 sprejel novo uredbo o medicinskih pripomočkih (v nadaljevanju MDR), z namenom zagotovitve
večje varnosti javnega zdravja in varnosti bolnikov ter uporabnikov medicinskih pripomočkov. Uredba je postala veljavna 26. maja 2017, v celoti pa se je začela uporabljati s 26. majem 2021.
MDR predstavlja nov zakonodajni okvir na področju medicinskih pripomočkov in je obvezujoča za vse države članice Evropskega gospodarskega prostora. Nadomešča direktivo o medicinskih pripomočkih (93/42/EGS) in direktivo o aktivnih medicinskih pripomočkih za vsaditev (90/385/EGS) in zakone in predpise, ki jih je vsaka država članica sprejela skladno s tema direktivama v preteklosti. V nasprotju z direktivami se uredba uporablja neposredno, zato je ni treba prenesti v nacionalno pravo.
Zahtevam uredbe morajo slediti vsi gospodarski subjekti, ki sodelujejo pri proizvodnji, uvozu ali distribuciji medicinskih pripomočkov, ki so namenjeni za uporabo v EU. Določa pravila za dajanje medicinskih pripomočkov na trg, omogočanje njihove dostopnosti na trgu in njihovo dajanje v uporabo in zadeva vse člene dobavne verige medicinskih pripomočkov. MDR ohranja vse zahteve direktiv, dodaja pa še nekaj novih. V Sloveniji je pristojni organ za izvajanje zahtev MDR Javna agencija Republike Slovenije za zdravila in medicinske pripomočke.
Medicinski pripomočki se v razrede delijo na podlagi tveganja, ki ga predstavljajo za uporabnika:
UDI – EDINSTVENI IDENTIFIKATOR PRIPOMOČKA
UDI je edinstveni identifikator, sestavljen iz numeričnih ali alfanumeričnih znakov, ki omogoča natančno identifikacijo posameznega medicinskega pripomočka na trgu. Sestavljen je iz UDI-DI (identifikator pripomočka) in UDI-PI (identifikator proizvodnje). Vsi proizvajalci, ki želijo svoje pripomočke tržiti na trgu EU bodo morali svoje pripomočke označiti z oznako UDI, prav tako pa bodo podatke o UDI šifrah morali poročati v EUDAMED bazo, s čimer se bo olajšala sledljivost medicinskih pripomočkov.
EUDAMED – EVROPSKA CENTRALNA BAZA MEDICINSKIH PRIPOMOČKOV
EUDAMED je spletni portal, ki bo omogočal izmenjavo informacij med gospodarskimi subjekti, pristojnimi organi, priglašenimi organi in Evropsko komisijo. Baza EUDAMED bo sestavljena iz šestih medsebojno povezanih modulov in bo imela osredno vlogo pri zagotavljanju podatkov o medicinskih pripomočkih, vključno z informacijami o kliničnih preiskavah in študijah učinkovitosti, ter podatkih o varnosti pripomočkov.
DISTRIBUCIJA MEDICINSKIH PRIPOMOČKOV IN FUNKCIJA DISTRIBUTERJEV V DOBAVNI VERIGI
Distributer za namene MDR pomeni vsako fizično ali pravno osebo v dobavni verigi, ki ni proizvajalec ali uvoznik in ki omogoča dostopnost pripomočka na trgu, dokler ta ni dan v uporabo. Uredba distributerjem nalaga novo ključno nalogo. Z reprezentativnim vzorčenjem morajo preveriti in zagotoviti, da so vsi pripomočki, ki jih distribuirajo, skladni z zahtevami, ki so opredeljene v členu 14 MDR, prav tako pa morajo poskrbeti, da so pogoji skladiščenja in prevoza pripomočkov skladni s tistimi, ki jih je določil proizvajalec.
PREHODNO OBDOBJE
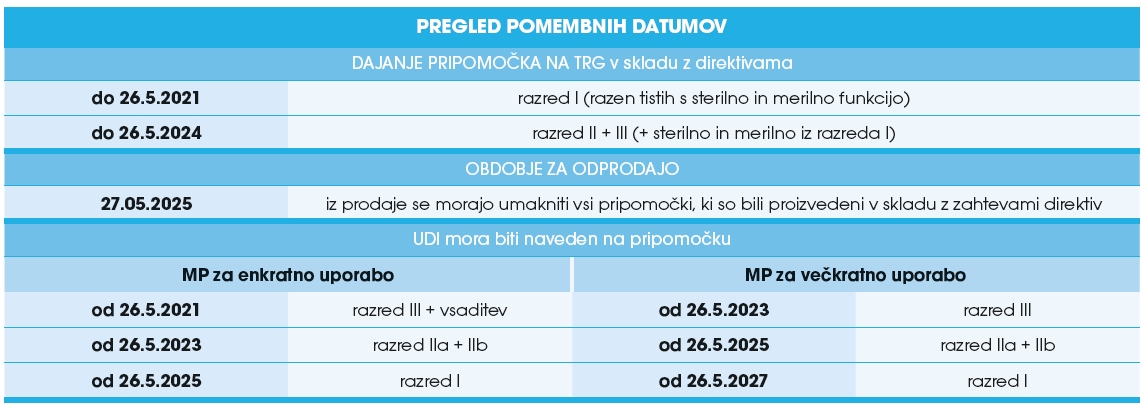
MDR opredeljuje tudi prehodno obdobje, ki je vzpostavljeno zato, da se preprečijo motnje v preskrbi medicinskih pripomočkov. V tem obdobju bodo lahko nekateri pripomočki, za katere so bili certifikati izdani na podlagi direktiv, na trg dani do 27. maja 2024, dostopni pa še do 27. maja 2025. Dodatno prehodne določbe opredeljujejo še datume za postopno namestitev oznake UDI na pripomočke različnih razredov in zahteve za registracijo v bazo EUDAMED.
Kemofarmacija v dobavni verigi medicinskih pripomočkov sodeluje v vlogi distributerja. Sodelujemo s približno 200 dobavitelji in tržimo nekaj čez 4000 medicinskih pripomočkov. Kot ključni člen verige smo se na uveljavitev MDR intenzivno pripravljali. V sodelovanju s širšo McKesson skupino in strokovnjaki iz različnih držav smo posodobili naš sistem kakovosti in zato lahko z gotovostjo trdimo, da naše poslovanje ostaja skladno z veljavno zakonodajo.
Julija Geršanov
referentka za regulativo
Okrajšave:
MDR – Uredba o medicinskih pripomočkih (EU) 2017/745 (Medical Device Regulation)
UDI – Edinstveni identifikator pripomočka (Unique Device Identifier)

Veletrgovec z najširšo ponudbo zdravil.
Veletrgovec, ki s svojimi storitvami kupcem ponuja najboljše rešitve - distribucija, informacije, svetovanje, poslovanje.
Veletrgovec, ki z zdravili in medicinskimi pripomočki pokriva vso Slovenijo.

več kot 180 zaposlenih
več kot 11.500 izdelkov na zalogi, neomejeno po naročilu
več kot 350 dobaviteljev
več kot 1.100 kupcev: vse javne in bolnišnične lekarne, večina zdravstvenih centrov, veterinarjev in specializiranih trgovin
Kemofarmacija website uses cookies with the aim of providing its web service, advertising systems and functionalities that would not be possible without them.
By continuing to use these websites, you agree to use cookies.
If you do not want to use cookies, you can deactivate them by going to your browser settings.